מחזור דחיסת אדים פשוט
Peer מחזור דחיסה משמש לקירור בעדיפות על מחזורי גז; השימוש בחום סמוי מאפשר לשחזר את זרימת הקירור בכמות רבה יותר של חום. זה עושה ציוד קומפקטי ככל האפשר.
נוזל לרתיחה ולאידוי - החלף בין הנוזל למצב הגזי בטמפרטורה, התלוי בלחץ שבתוך נקודת הקפיאה שלו ובטמפרטורה הקריטית (ראה איור 2.2). בהרתחה עליו להגיע לחום האידוי והעיבוי בחום הסמוי מועבר.
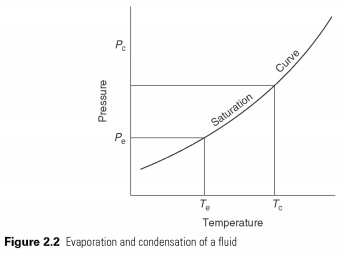
החום נמצא במצב נוזלי בטמפרטורות ולחצים נמוכים, ומספק את החום הסמוי כדי להתאדותו. הצמד, ואז באופן אוטומטי הוא דחוס ללחץ גבוה, ייתכן שטמפרטורת הרוויה המתאימה לחום הסמוי שלו תסרב, ולכן הוא מחליף בחזרה לנוזל. המחזור מוצג באיור 2.3. השפעת קירורו של מוביל החום בתהליך האידוי, שהוא שינוי האנטלפיה בין נוזל לאדים, ומשאיר ЁёЃї °µµµµЊЊ.
כדי לחקור תהליך זה יותר מקרוב, מהנדסי קירור משתמשים באנטלפיה לחץ או בתרשים Ph (איור.
2.4). תרשים זה הוא דרך נוחה לתאר את שלבי הנוזל והגז של החומר. על הציר האנכי, לחץ P, ואופקית, h, אנטלפיה. עקומת הרוויה מגדירה את הגבול של נוזל טהור וגז או אדים טהורים. האזור הראה אדים, נוזלים מחוממים-עליים. האזור מסומן על ידי נוזל נוזל-קירור-על. בלחצים מעל העקומה העליונה, אין הבחנה בין נוזלים לאדים. מעל לחץ זה לא ניתן להנזת גז. זה נקרא הלחץ הקריטי. באזור שמתחת לעיקול, כלומר תערובת של נוזלים ואדים.
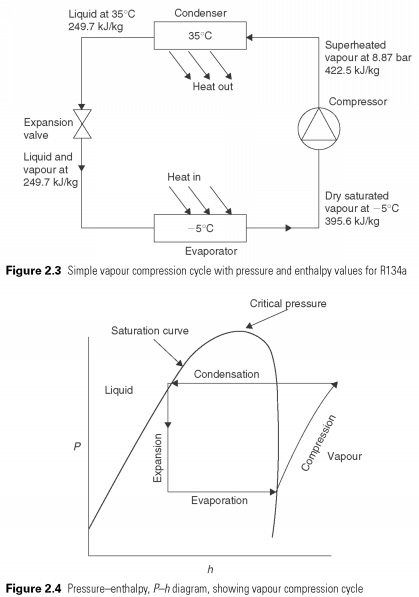
מחזור דחיסת אדים פשוט מוצג בתרשים Ph בתרשים 2.4. תהליך אידוי או אידוי נוזל הקירור הוא תהליך לחץ מתמיד ומכאן שהוא קו אופקי. בתהליך דחיסת האנרגיה המשמשת לדחיסת אדים הופך לחום ומגביר את הטמפרטורה ואת האנטלפיה שלו, כך שבסופו של מצב דחיסת האדים במצעדים המחוממים-עליים ומחוץ לעיקול הרוויה. תהליך בו חום הדחיסה מעלה את האנטלפיה של הגז המכונה דחיסה אדיאבטית. לפני העיבוי יכול להתחיל אדים חייבים להתקרר. טמפרטורת הדחיסה הסופית כמעט תמיד מתחת טמפרטורת עיבוי כפי שמוצג, ולכן כמות מסוימת של חום נדחית בטמפרטורות מעל טמפרטורת העיבוי. זה מייצג סטייה מהמחזור האידיאלי. תהליך העיבוי בפועל מוצג של הקווים האופקיים בתוך עקומת הרוויה.
כאשר פשוט מחזור דחיסת אדים מוצג בתרשים האנטרופיה לטמפרטורה (איור 2.5), ניתן לזהות חריגות ממעגל הקרנון ההפוך לפי המקומות המוצלים. תהליך הדחיסה Adiabatic נמשך מעבר לנקודה בה מגיעים לטמפרטורת העיבוי. המשולש המוצל מייצג את כמות העבודה הנוספת שניתן להימנע ממנה אם תהליך הדחיסה השתנה לאיזותרמיה (כלומר בטמפרטורה קבועה) ברגע בו הוא ממשיך עד להשגת לחץ העיבוי.
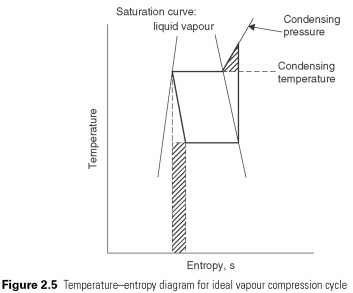
הרחבת האנטלפיה המתמדת של התהליך. הוא יוכן בצורת קו אנכי על סכמת Ph. שום חום לא נספג או נדחה במהלך התפשטות הנוזל פשוט עובר דרך השסתום. לאחר הפחתת הלחץ בשסתום צריך להוביל לירידה מקבילה בטמפרטורה של אדי הנוזל הבזק כדי להסיר את האנרגיה לקירור. נפח הנוזל, ובכך מגדיל את כמות השסתומים של הגז המשויך, מה שמוביל לשמו, ה- שסתום התפשטות. למשל, לא נעשה שום ניסיון לשחזר אנרגיה מתהליך ההרחבה. בעזרת הטורבינה. זו הסטייה השנייה מהמחזור המושלם. עבודה שאפשר לשחזר אותה מיוצגת על ידי המלבן המוצל באיור 2.5 .....
|


