حرارة
تعتبر الحرارة أحد أشكال الطاقة العديدة وتتشكل من المصادر الكيميائية. يمكن لدفء حرارة جسمه أو الطاقة الداخلية ، والتغيير في هذه الطاقة أن يبيّن كيف تتغير درجة الحرارة أو تتغير بين الدول الصلبة والسائلة والغازات الغازية.
قد يكون لهذه المسألة أيضًا أشكال أخرى من الطاقة ، المحتملة أو الحركية ، اعتمادًا على الضغط والموقف والحركة. Enthalpy هو مجموع الطاقة الداخلية وتدفق العمل ويعطى بواسطة:
H = u + Pv
في هذه العملية ، عندما يكون هناك عامل تدفق ثابت ، لن تتغير Pv بشكل كبير ، والفرق في المحتوى الحراري هو مقدار الحرارة المكتسبة أو المفقودة.
يمكن التعبير عن Enthalpy بشكل إجمالي أعلى من الصفر المطلق ، أو أي أساس آخر ، أنه مريح. غالبًا ما يتم عرض المحتوى الحراري المجدول في العمل اليدوي أعلاه ، ودرجة الحرارة المرجعية من -40C ، لأن هذا هو أيضًا مقياس فهرنهايت القديم -40. في أي عملية حسابية ، يجب دائمًا التحقق من الشرط الأساسي لتجنب الأخطاء التي ستحدث في حالة استخدام قاعدتي بيانات مختلفتين.
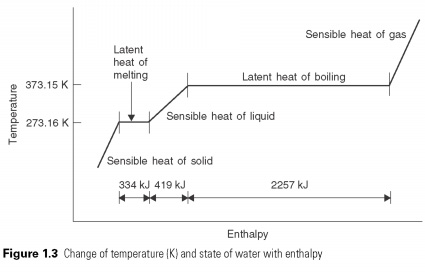
إذا شعر التغير في المحتوى الحراري بأنه تغير في درجة الحرارة ، فإنه يسمى الحرارة المعقولة.
يتم التعبير عنها كقدرة حرارية محددة ، أي التغير الحراري في درجة التغير في درجة الحرارة ، kJ / (كجم). إذا لم يكن هناك تغير في درجة الحرارة ، ولكن تغير في الحالة (سائل صلب ، غاز سائل ، أو العكس بالعكس) ، فإنه يطلق عليه الحرارة الكامنة. يتم التعبير عن ذلك بوحدة الكيلوجرام / كجم ، لكنه يعتمد على درجة حرارة الغليان ، وبالتالي ، كقاعدة عامة ، مؤهل لهذا الشرط. نتيجة للتغيرات الإجمالية يمكن أن تظهر على الرسم البياني لدرجة الحرارة و المحتوى الحراري (الشكل 1.3).
....
|

