Vienkāršs tvaika saspiešanas cikls
pāris saspiešanas cikls izmanto dzesēšanai, nevis gāzes cikliem; Izmantojot latentu siltumu, dzesēšanas šķidruma plūsmā var atgūt daudz lielāku siltuma daudzumu. Tas padara iekārta pēc iespējas kompakts.
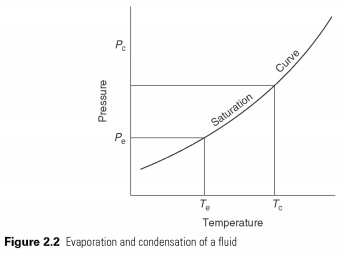
Šķidrums vārās un iztvaiko - mainās starp šķidrumu un gāzveida stāvokli temperatūrā, kas ir atkarīga no spiediena tā sasalšanas temperatūrā un kritiskās temperatūras (sk. 2.2 att.). Vārot, viņam vajadzētu iegūt latento iztvaikošanas siltumu, un kondensāts latentajā siltumā tiek pārnests.
Siltums ir šķidrā stāvoklī zemā temperatūrā un spiedienā, nodrošinot latento siltumu, lai tas iztvaikotu. Pāris, pēc tam automātiski tiek saspiests līdz augstam spiedienam, var tikt atteikta piesātinājuma temperatūra, kas atbilst tā latentajam karstumam, tāpēc viņš mainās atpakaļ šķidrumā. Cikls ir parādīts 2.3. Attēlā. Siltumnesēja atdzišanas ietekme iztvaikošanas procesā, tas ir, entalpijas izmaiņas starp šķidrumu un tvaiku, atstājot РёСЃРїР ° ритР»Њ.
Lai rūpīgāk izpētītu šo procesu, saldēšanas iekārtu inženieri izmanto spiediena entalpiju vai Ph diagrammu (att.
2.4). Šī diagramma ir ērts veids, kā aprakstīt vielas šķidruma un gāzes fāzes. Uz vertikālās ass spiediens P un horizontāli h, entalpija. Piesātinājuma līkne nosaka tīra šķidruma un tīras gāzes vai tvaika robežu. Reģionā parādījās tvaiki, šķidrs pārkarsēts tvaiks. Reģionu iezīmē šķidrums, pārdzesēts šķidrums. Pie spiediena virs augšējās līknes šķidrums un tvaiks nav atšķirīgi. Virs šī spiediena gāzi nevar sašķidrināt. To sauc par kritisko spiedienu. Laukumā zem līknes, ti, šķidruma un tvaiku maisījums.
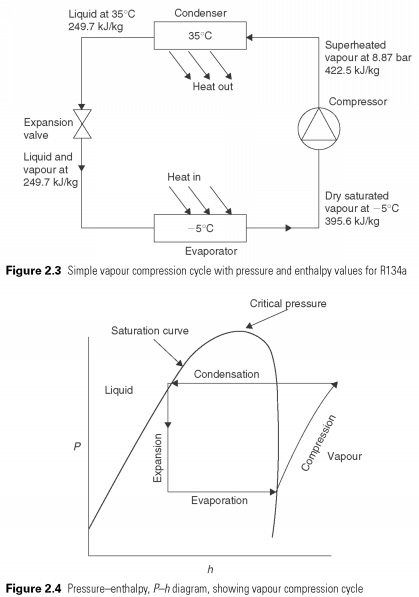
Vienkāršs tvaika saspiešanas cikls ir uzlikts uz Ph diagrammas 2.4. attēlā. Dzesēšanas šķidruma iztvaikošanas vai iztvaikošanas process ir pastāvīgs spiediena process, un līdz ar to tas ir horizontāls. Tvaika saspiešanai izmantotās enerģijas saspiešanas procesā pārvēršas siltumā un paaugstina tā temperatūru un entalpiju tā, ka tvaika saspiešanas stāvoklī pārkarsētajās diagrammās un ārpus piesātinājuma līknes tiek sasniegts stāvoklis. Process, kurā saspiešanas siltums paaugstina gāzes entalpiju, ko sauc par adiabātisko saspiešanu. Pirms kondensācijas sākšanās tvaiki ir jāatdzesē. Galīgā saspiešanas temperatūra gandrīz vienmēr ir zemāka kondensācijas temperatūra kā parādīts, un līdz ar to noteikts siltuma daudzums tiek izmests temperatūrā virs kondensācijas temperatūras. Tas norāda uz novirzi no ideālā cikla. Faktiskais kondensācijas process ir parādīts horizontālajām līnijām piesātinājuma līknē.
Kad vienkārši tvaika saspiešanas cikls ir parādīts temperatūras entropijas diagrammā (2.5 att.), novirzes no apgrieztā Carnot cikla var identificēt ar aizēnotajām vietām. Adiabātiskās saspiešanas process turpinās ārpus vietas, kur tiek sasniegta kondensācijas temperatūra. Ēnotais trīsstūris apzīmē papildu darba apjomu, no kura var izvairīties, ja kompresijas process tiek mainīts uz izotermisku (ti, nemainīgā temperatūrā) brīdī, kad tas turpinās, līdz tiek sasniegts kondensācijas spiediens.
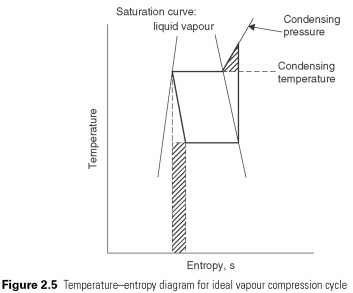
Procesa pastāvīgas entalpijas paplašināšanās. To sagatavo vertikālas līnijas veidā uz Ph shēmas. Siltums netiek absorbēts vai noraidīts laikā, kad šķidrums izplešas tikai caur vārstu. Pēc spiediena samazināšanas vārstā vajadzētu izraisīt atbilstošu šķidruma tvaiku temperatūras pazemināšanos, lai noņemtu enerģiju dzesēšanai. Tādējādi šķidruma tilpums palielina saistītās gāzes vārsta daudzumu, kas noved pie tā nosaukuma izplešanās vārsts. Piemēram, nemēģina atgūt enerģiju no paplašināšanās procesa. ar turbīnas palīdzību. Šī ir otrā novirze no perfekta cikla. Darbu, kuru potenciāli var atjaunot, 2.5. Att. Attēlo apēnots taisnstūris ...
|


